Apa yang dimaksud dengan atom?
Dalam dinamika ilmu pengetahuan, teori atom terus disempurnakan melalui hasil seragkaian metode ilmiah yang berkembang dari waktu ke waktu. Definisi atom tercantum dalam teori-teori terdahulu hingga teori yang digunakan sampai saat ini. Teori dapat memberikan informasi tentang definisi maupun struktur atom.
Dinamika Teori Atom
Teori pertama tentang atom digagas oleh Demokritus (Yunani) yang menyatakan bahwa atom adalah partikel-partikel yang kecil, keras, berbentuk, berukuran, dan memiliki berat. Teori ini merupakan cikal bakal pengembangan ilmu pengetahuan tentang atom. Lalu, pada tahun 1804, John Dalton, seorang ahli kimia dari Inggris memberikan gagasannya yang dikenal dengan nama Teori Atom Dalton dengan 4 postulatnya, yaitu:
- Materi terdiri atas partikel yang tidak dapat dibagi-bagi lagi, tidak dapat diciptakan atau dimusnahkan, yang disebut atom;
- Atom-atom dalam suatu unsur yang sama adalah identik, artinya memiliki berat, ukuran, dan sifat-sifat yang sama;
- Atom dari unsur yang berbeda akan memiliki berat, ukuran, dan sifat yang berbeda;
- Jika atom-atom bergabung membentuk seyawa, penggabungan atom-atom ini menurut perbandingan bilangan bulat sederhana.
Kemunculan 4 postulat ini mendorong para ahli untuk melakukan penelitian lebih lanjut. Alhasil, keempat postulat itu terkoreksi. Atom bukan lagi bagian terkecil dari materi karena ditemukan partikel-partikel yang lebih kecil dari atom, yaitu partikel-partikel penyusun atom, seperti elektron, proton, dan neutron. Oleh karena itu, postulat 1 terkoreksi.
Atom-atom dalam suatu unsur yang sama tidaklah identik karena terdapat unsur-unsur yang memiliki isotop. Isotop adalah atom-atom yang sama dengan jumlah proton yang sama, tetapi jumlah neutronnya berbeda, seperti contohPenggabungan atom-atom dalam membentuk senyawa tidak selalu menurut perbandingan bilangan bulat sederhana karena ditemukannya senyawa-senyawa makromolekul, seperti protein, karbohidrat, lipid, senyawa polimer, dan senyawa makromolekul lainnya yang merupakan rangkaian panjang monomer yang perbandingan atom-atom penyusunnya jauh dari kata sederhana. Oleh karena itu, postulat 4 terkoreksi.
Teori-teori yang digagas para ahli dapat memberikan informasi mengenai definisi maupun struktur atom. Sampai sejauh ini, dari kedua teori yang telah dijabarkan, dapat kita garis bawahi definisi atom adalah suatu partikel yang berbentuk, berukuran, dan bermassa yang tersusun atas elektron, proton, dan neutron dan merupakan bagian paling dasar penyusun suatu materi.
Teori Atom Thomson
Pada tahun 1904, John Josep Thomson menggagas suatu teori yang dikenal dengan nama Teori Atom Thomson. Dalam teorinya, Thomson menyatakan bahwa atom berbentuk seperti agar-agar yang tersusun atas muatan listrik positif (proton) dan negatif (neutron). Proton tersebar merata dalam bulatan atom dengan elektron tertanam di dalamnya. Apabila dilukiskan, Teori Thomson ini memberikan informasi tentang struktur atom. Apabila Teori Dalton mengatakan bahwa atom adalah sesuatu yang tidak dapat dibagi lagi, Thomson memberikan gambaran bahwa struktur atom terbagi atas partikel-partikel penyusunnya. Struktur atom yang demikian dikenal dengan sebutan “roti kismis” karena bentuknya mirip dengan roti bulat yang dipenuhi oleh kismis—elektron.
 |
| sumber: https://www.ilmukimia.org/ |
Teori Atom Rutherford
Gambaran struktur atom pada teori Thomson terkoreksi oleh percobaan Rutherford, yaitu percobaan Penghamburan Sinar α Pada Lempeng Emas. Percobaan tersebut menunjukkan hasil sebagai berikut.
- Banyak sinar α yang terhambur dengan sudut hambur yang besar. Hal ini tidak mungkin terjadi apabila struktur atom seperti yang dikemukakan oleh Thomson. Model atom Thomson memungkinkan sinar α bergerak lurus dengan sedikit pembelokan, bukan terhambur dengan sudut yang besar;
- Beberapa sinar α dipantulkan kembali. Ini menunjukkan bahwa terdapat medan listrik yang kuat di sekitar inti. Hal ini tidak sesuai dengan teori Thomson yang mengatakan bahwa proton tersebar merata dalam bulatan atom;
- Banyaknya sinar α yang diteruskan menunjukkan bahwa sebagian besar atom adalah ruang hampa.
Ketiga hasil percobaan tersebut tidak menunjukkan bahwa struktur atom adalah sebagaimana yang dikemukakan oleh Thomson. Oleh karena itu, teori Thomson terkoreksi.
Dari hasil percobaannya itu, Rutherford berkesimpulan bahwa:
- Sebagian besar atom adalah ruang hampa dengan inti yang sangat kecil dan bermuatan positif serta dikelilingi oleh elektron yang jumlahnya sama dengan inti;
- Atom dianalogikan sebagai sistem tata surya kita, dengan matahari sebagai inti dan planet-planet yang mengitarinya sebagai elektron;
- Atom bermuatan netral karena jumlah elektron sama dengan jumlah proton pada inti;
- Sebagian besar massa atom adalah massa inti.
Berdasarkan hasil percobaan dan kesimpulan tersebut, berikut adalah struktur atom menurut Rutherford.
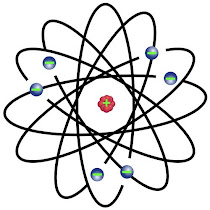 |
| sumber: https://spada.itn.ac.id/ |
Kemunculan teori Rutherford memang menyempurnakan teori Thomson. Namun, di sisi lain, para ahli bertanya-tanya, bagaimana mungkin inti atom yang bermuatan positif dapat berdekatan dengan elektron yang bermuatan negatif? Karena menurut teori Termodinamika Klasik, dalam keadaan diam, apabila terjadi perbedaan muatan, akan ada tarik-menarik antar muatan-muatan tersebut, yang artinya elektron akan jatuh ke inti.
Rutherford menjawab bahwa elektron tidak akan jatuh ke inti karena adanya gaya sentrifugal yang akan membuat elektron terus bergerak. Jawaban tersebut juga terbantah karena menurut Hukum Elektromagnetik, suatu partikel bermuatan yang terus bergerak akan memancarkan radiasi terus-menerus dan kecepatannya akan berkurang, sehingga suatu saat elektron akan jatuh ke inti.
Teori Atom Niels Bohr
Pada tahun 1913, Niels Bohr berhasil menyempurnakan model atom Rutherford menggunakan Teori Kuantum Planck yang menyatakan bahwa atom hanya dapat memancarkan atau menyerap radiasi dalam bentuk kuantum yang energinya berbanding lurus dengan frekuensi radiasi. Dengan munculnya teori ini, terjawab sudah kekurangan dari Teori Rutherford.
Untuk memperjelas model atomnya, Bohr mengemukakan 4 postulat, yaitu:
- Elektron bergerak dalam lintasannya masing-masing yang membentuk melingkar mengelilingi inti dengan jari-jari (r) yang menentukan sudut kelipatan dari satuan h/2p;
- Elektron memiliki energi pemancaran radiasi pada keadaan tertentu yang dapat dihitung dengan persamaan:
dengan:
m = massa elektron
e = muatan elektron
Z = muatan inti
h = tetapan Planck
n = bilangan bulat = 1,2,3,…
Elektron yang berada dalam keadaan dasar (stasioner) atau ground state tidak memancarkan radiasi.
3. Elektron akan berpindah dari keadaan stasioner dengan tingkat energi E1 ke keadaan dengan tingkat energi yang lebih tinggi E2 apabila atom menyerap energi dengan frekuensi ν, sehingga:
E2 - E1 = hv
4. Elektron yang berpindah dari keadaan tingkat energi rendah ke keadaan tingkat energi tinggi disebut elektron tereksitasi. Energi akan dipancarkan dengan frekuensi yang sama apabila elektron kembali ke keadaan stasioner.
Dengan postulat itu, didapatkan pemodelan struktur atom sebagai berikut.
 |
| sumber: https://previews.123rf.com/ |
Model atom Bohr hanya dapat dipakai untuk menghitung frekuensi garis-garis spektrum dari atom H dan ion-ion berelektron satu. Frekuensi garis-garis spektrum dari atom-atom atau ion-ion dengan dua elektron atau lebih tidak dapat dihitung menggunakan model atom ini.
Teori Atom Mekanika Gelombang
Pada tahun 1924, De Broglie mengemukakan bahwa materi dapat bersifat sebagai gelombang yang panjang gelombanganya (λ) dapat dihitung dengan persamaan:
λ = h/mv
dengan;
λ= panjang gelombang
h= konstanta Planck
m= massa partikel
v= kecepatan partikel
Hubungan berbanding terbalik antara panjang gelombang dan massa partikel menunjukkan bahwa semakin kecil massa partikel, semakin besar panjang gelombangnya, sehingga sifat gelombang dari partikel penyusun atom semakin besar (nyata).
Penggambaran model atom menurut teori ini dibantu oleh Asas Ketidakpastian Heinsberg dan Fungsi Gelombang Schrodinger. Melalui perhitungan fungsi yang sangat rumit, didapatkan sketsa struktur atom sebagai berikut.
 |
| sumber: https://www.zenius.net/ |
Gambar tersebut menunjukkan inti yang dikelilingi oleh awan elektron. Model atom ini dapat memperkirakan kedudukan elektron terhadap inti menggunakan bilangan kuantum.
Penutup
Hingga saat ini, teori atom yang digunakan adalah teori atom Niels Bohr dan Mekanika Gelombang. Bilangan kuantum dalam Teori Mekanika Gelombang digunakan untuk memperkirakan kedudukan elektron terhadap inti, sedangkan model atom Niels Bohr sering digunakan dalam menentukan konfigurasi elektron.












0 comments:
Posting Komentar